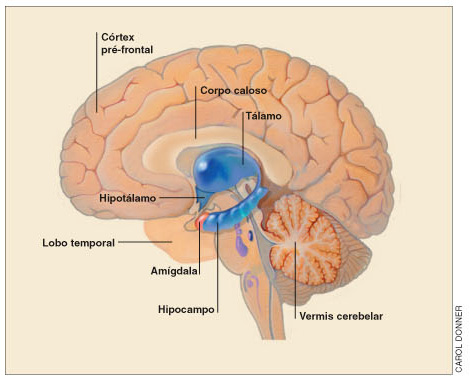
DOENÇAS DO SISTEMA ENDOCRINO
- Doenças da Hipófise

ACROMEGALIA E GIGANTISMO
A acromegalia é uma doença crônica que surge quando a hipófise, glândula de secreção interna, produz quantidades excessivas de hormônio do crescimento (GH). O nome acromegalia é reservado à produção excessiva de GH na vida adulta, quando as cartilagens de crescimento já se encontram fechadas, inativas. Quando o excesso de GH ocorre na infância ou na puberdade, antes do fechamento dessas cartilagens, a ação do GH provoca crescimento excessivo na estatura, e o quadro recebe o nome de gigantismo.
Funções do hormônio do crescimento:
Produzido pela hipófise, o GH promove o crescimento de quase todas as células e tecidos do corpo humano. Ele age forçando a produção de fatores de crescimento intermediários, predominantemente liberados pelo fígado. Um deles, o IGF-1, simula as ações da insulina e atua em vários mecanismos bioquímicos envolvidos no crescimento e na multiplicação das células.
Causas:
Acromegalia e gigantismo são causados pela produção exagerada de GH e de IGF-1. Em 98% dos casos, a produção excessiva está associada à presença de tumores benignos da hipófise: os adenomas. Os 2% restantes compreendem casos raríssimos de tumores malignos instalados na hipófise, de tumores que estimulam a hipófise a produzir GH ou de tumores produtores de GH localizados no pâncreas, pulmões ou em outros tecidos.
Sintomas:
A acromegalia pode causar mudanças na aparência física, mas como a doença costuma evoluir no decorrer de vários anos, seus sinais podem ser confundidos com os do envelhecimento. Muitas vezes, o diagnóstico é feito casualmente por um médico que reconhece o aspecto físico do portador da doença num ambiente público ou quando se compara a fotografia atual do paciente com uma antiga.
As características mais importantes da aparência física são:
- mãos e pés crescem, os sapatos não servem mais, os anéis não entram nos dedos;
- alargamento da região frontal e da testa;
- o queixo fica proeminente, dando ao rosto um aspecto característico;
- espaçamento entre os dentes e perda dentária;
- aumento do volume do tórax, do nariz e dos genitais;
- os lábios engrossam.
Como GH e IGF-1 agem em todos os tecidos do corpo, a produção excessiva afeta múltiplas funções orgânicas, provocando as seguintes alterações:
- A pele se torna espessa, oleosa, propensa à acne, deformada pelo aparecimento de pregas. Os pacientes apresentam sudorese exagerada;
- Alterações respiratórias: obstrução de vias aéreas, aumento das dimensões da língua, dificuldade de respiração durante o sono e espessamento das cordas vocais que tornam a voz mais grave;
- Alterações cardiovasculares: aumento do volume do coração, hipertensão arterial, insuficiência cardíaca, arritmias, fadiga;
- Alterações gastrointestinais: aumento de volume do fígado, pâncreas e outros órgãos. Pode haver formação de pólipos intestinais;
- Alterações metabólicas/endócrinas: diabetes, intolerância a carboidratos, resistência à insulina, aumento dos níveis de colesterol e dos triglicérides, nódulos na tireóide, diminuição da libido, saída de leite pelos mamilos da mulher e alterações menstruais;
- Alterações músculo-esqueléticas: dores articulares, osteoartrite, formigamentos e alterações de sensibilidade da pele, síndrome do túnel do carpo, osteopenia (diminuição da massa óssea) e osteoporose.
- Alterações neurológicas: dor de cabeça persistente;
- Alterações oftálmicas: distúrbios visuais e redução do campo visual.
Diagnóstico:
Quando a aparência física e o quadro clínico sugerem acromegalia, o diagnóstico pode ser confirmado por dois exames de sangue: as dosagens de GH e de IGF-1.Um único exame alterado de GH não permite fechar o diagnóstico, porque a hipófise libera esse hormônio de forma irregular, no decorrer do dia. Para obter dados mais confiáveis, os médicos fazem um tipo de exame de sangue no qual o GH é dosado depois da ingestão de uma solução açucarada. Os níveis de IGF-1 são bem mais constantes no decorrer do dia. Valores elevados quase sempre estão associados à acromegalia. Depois que o diagnóstico foi estabelecido, uma série de exames de imagem (tomografia computadorizada, ressonância nuclear magnética, etc.) é realizada para detectar a presença de tumores na hipófise ou em localizações mais raras.
Tratamento:
Os objetivos do tratamento são:
- Reduzir as concentrações de GH e de IGF-1 para os níveis normais;
- Aliviar a pressão que tumores situados na hipófise possam exercem sobre o nervo óptico e áreas cerebrais vizinhas;
- Preservar as funções hipofisárias;
- Reverter ou melhorar os sinais e os sintomas da acromegalia.
As opções de tratamento incluem:
- Cirurgia
A cirurgia tem índices de cura de 80% a 90% nos casos em que os adenomas (tumores benignos de aspecto glandular) medem menos de 1 cm.
Quando ultrapassam essa dimensão, os índices caem para menos de 50%.Quando a cirurgia é realizada com sucesso, a aparência facial e o inchaço dos tecidos começam a melhorar em poucos dias. Mesmo assim, os níveis hormonais podem não retornar ao normal e exigir tratamento complementar com medicamentos. A principal complicação cirúrgica é a lesão do tecido hipofisário adjacente, que pode exigir reposição hormonal para o resto da vida.
- Radioterapia
É consenso entre os especialistas que a radioterapia NÃO deve ser usada como primeira opção terapêutica, exceto quando os tumores não podem ser removidos cirurgicamente, quando a doença persiste depois da operação, quando o tratamento com medicamentos falha ou quando os pacientes recusam outras opções. Depois do tratamento radioterápico, a função hipofisária costuma declinar gradativamente. Depois de 10 anos, 70% dos casos necessitam de reposição hormonal prolongada.
- Tratamento clínico
Três tipos de medicamentos são empregados no tratamento da acromegalia:
1 – Agonistas dopaminérgicos: têm eficácia em apenas 10% dos casos. São usados preferencialmente quando os níveis de prolactina estão aumentados;2 – Análogos da somatostatina: constituem o tratamento clínico de primeira linha, uma vez que 96% dos tumores que secretam GH apresentam em suas células receptores para um fator de crescimento celular conhecido como somastatina. Como as drogas deste grupo (lanreotida e octeotrida) ligam-se a esses receptores, são dotadas da propriedade de regular a produção de GH e o crescimento celular. Nos últimos 10 anos, a aplicação de octeotrida por via intramuscular tornou-se a forma de tratamento clínico da acromegalia mais prescrita e estudada. A administração de octeotrida além de reduzir os níveis de GH e de IGF-1, diminui os índices de mortalidade, a freqüência dos batimentos cardíacos, melhora a função dos ventrículos, a resistência à atividade física e faz regredirem os sinais e sintomas da acromegalia;3 – Antagonistas do receptor de GH: são medicamentos úteis quando existir resistência aos análogos da somatostatina. Embora normalizem os níveis de IGF-1 em cerca de 95% dos casos, seu efeito sobre o crescimento dos tumores hipofisários é questionável.
2. Doenças Osteometabólicas

AS GLÂNDULAS PARATIREÓIDES
As glândulas paratireóides, normalmente em número de quatro, estão situadas no pescoço, embebidas na face posterior da glândula tireóide. Essas pequenas glândulas passam despercebidas e podem ser acidentalmente removidas no momento da cirurgia de tireóide. A retirada cirúrgica inadvertida é a causa mais comum de hipoparatireoidismo.
O paratormônio, o hormônio protéico originário das glândulas paratireóides, regula o metabolismo do cálcio e do fósforo. A secreção aumentada de paratormônio resulta em absorção aumentada de cálcio a partir do rim, intestino e ossos, elevando, por conseguinte, o nível sangüíneo de cálcio. Algumas ações desse hormônio são aumentadas pela presença da vitamina D. O paratormônio também tende a diminuir o nível sanguíneo de fósforo.
O excesso de paratormônio pode resultar em níveis acentuadamente elevados de cálcio sérico, uma situação com risco de vida potencial. Quando o produto de cálcio sérico e fósforo sérico aumentam, o fosfato de cálcio pode precipitar-se em vários órgãos do corpo e gerar a calcificação tecidual.
O débito do paratormônio é regulado pelo nível sérico de cálcio ionizado. O cálcio sérico aumentado resulta em diminuição da secreção de paratormônio, formando um sistema de retro alimentação negativa.
HIPERPARATIREOIDISMO
O hiperparatireoidismo, que é causado pela produção excessiva de hormônio paratireóideo pelas glândulas paratireóides, caracteriza-se por descalcificação óssea e desenvolvimento de cálculos renais contendo cálcio.
O hiperparatireoidismo primário ocorre com freqüência duas a quatro vezes mais nas mulheres que nos homens e é observado mais amiúde nos pacientes entre 60 e 70 anos de idade. A incidência da doença é rara em crianças com menos de 15 anos de idade e aumenta 10 vezes entre 15 e 65 anos de idade. Metade dos pacientes atualmente diagnosticados com hiperparatireoidismo não apresenta sintomas.
O hiperparatireoidismo secundário, com manifestações similares, ocorre em pacientes com insuficiência renal, em conseqüência da retenção de fósforo, estimulação aumentada das glândulas paratireóides e secreção aumentada do paratormônio.
Manifestações clínicas:
O paciente pode não apresentar sintomas ou pode experimentar sinais e sintomas decorrentes do envolvimento de vários sistemas orgânicos. Apatia, fadiga, fraqueza muscular, náuseas, vômitos, constipação, hipertensão e arritmias cardíacas podem acontecer – todos atribuíveis a uma concentração aumentada de cálcio no sangue. As manifestações psicológicas podem variar desde a irritabilidade emocional e a neurose até a psicose provocada pelo efeito direto do cálcio sobre o cérebro e sistema nervoso. Um aumento no cálcio produz uma diminuição no potencial de excitação do tecido nervosos e muscular.
A formação de cálculos em ambos os rins, ligada à excreção urinaria aumentada de cálcio e fósforo, é uma das complicações importantes do hiperparatireoidismo e ocorre em 55% dos pacientes com hiperparatireoidismo primário. A lesão renal resulta da precipitação do fosfato de cálcio na pelve renal e no parênquima, resultando em cálculos renais ( nefrolitíase), enais ( nefrolitiase) nquima,re em 55% dos pacientes com hiperparatireoidismo primario. vdade.
Os sintomas musculoesqueléticos que acompanham o hiperparatireoidismo podem resultar da desmineralização dos ossos ou dos tumores ósseos compostos de células gigantes benignas, oriundas do crescimento excessivo dos osteoclastos, o paciente pode desenvolver dor e sensibilidade esquelética, em especial nas costas e articulações; a dor na sustentação do peso; fraturas patológicas; deformidades; e encurtamento da estatura corporal. A perda óssea atribuível ao hiperparatireoidismo aumenta o risco de fratura. A incidência de ulcera péptica e pancreatite mostra-se aumentada com o hiperparatireoidismo e pode ser responsável por muitos dos sintomas gastrointestinais que acontecem.
Histórico e Achados Diagnósticos:
O hiperparatireoidismo primário é diagnosticado pela elevação persistente dos níveis de cálcio e por um nível elevado de paratormônio. Os radioimunoensaios para o paratormônio são sensíveis e fazem a diferenciação entre o hiperparatireoidismo primário e as outras causas de hipercalcemia em mais de 90% dos pacientes com níveis séricos elevados de cálcio. Um nível sérico elevado isolado de cálcio é um achado inespecífico, porque os níveis séricos podem estar alterados pela dieta, medicamentos e alterações renais e ósseas. As alterações ósseas podem ser detectadas na radiografia ou no imageamento ósseo na doença avançada. O teste do anticorpo para o hormônio paratireóideo é utilizado para diferenciar entre o hiperparatireoidismo primário e a malignidade como causa da hipercalcemia. O ultra-som, a IRM, o imageamento com tálio e a biopsia com agulha fina foram utilizados para avaliar a função das paratireóides e para localizar cistos, adenomas ou hiperplasia paratireóidea.
Complicações do hiperparatireoidismo: Crise Hipercalcêmica
A crise hipercalcêmica aguda pode acontecer no hiperparatireoidismo. Isso ocorre com a elevação extrema dos níveis séricos de cálcio. Os níveis de cálcio sérico superiores a 15 mg/dl (3,7 mmol/l) resultam em sintomas neurológicos, cardiovasculares e renais.
O tratamento inclui a reidratação com grandes volumes de líquidos endovenosos, agentes diuréticos para promover a excreção renal do excesso de cálcio e a terapia com fosfato para corrigir a hipofosfatemia e diminuir os níveis séricos de cálcio por promover a deposição do cálcio no osso e reduzir a absorção gastrointestinal de cálcio. Os agentes citotóxicos (mitramicina), calcitocina e diálise podem ser utilizados em situações de emergência para diminuir rapidamente os níveis séricos de cálcio. O paciente em crise hipercalcêmica aguda necessita da intima monitorização para as complicações com risco de vida e para a reversão dos níveis séricos de cálcio.
Tratamento Médico:
A cirurgia (paratireoidectomia) é o único tratamento definitivo. Sempre que: a) cálcio sérico >12 mg%; b) marcada hipercalciúria (>400mg/24h); c) qualquer manifestação de hiperparatireoidismo primário (nefrolitíase, osteíte fibrosa cística, doença neuromuscular clássica); doença marcada redução na densidade do osso cortical (>2 desvios padrão); e) redução no clearance de creatinina na ausência de outra causa; f) idade < 50anos. Se o paciente não tem cirurgias prévias de pescoço e o cirurgião é experiente, a cirurgia tem sucesso em 95% dos casos, não havendo necessidade de se realizar testes de localização pré-operatórios. Entretanto, se estas condições não são obedecidas, testes de imagem são realizados. A confirmação da localização por dois destes métodos é suficiente para se ter uma localização confiante. Nos casos difíceis, arteriografia e coleta de amostras em vasos seletivos são necessárias. A extensão da cirurgia vai variar com a causa do hiperparatireoidismo. Nos casos de adenoma, o tumor é removido e as outras três glândulas são biopsiadas; alguns não fazem as biópsias de rotina se as glândulas parecem normais, diminuindo assim a incidência de hipoparatireoidismo pós-cirúrgico. Na hiperplasia das 4 glândulas, retira-se 3 glândulas e metade da que mais parecer normal (paratireoidectomia subtotal). Se o paciente tem NEM tipo I, alguns centros realizam paratireoidectomia total com auto-transplante no antebraço, devido à alta incidência de recorrência. Em outra técnica cirúrgica, faz-se abordagem apenas unilateral, retirando-se o adenoma e não se explora o lado contralateral, desta forma, diminuem-se a morbidade (hipoparatireoidismo e lesão de nervos) e o tempo cirúrgicos. Porém, em 7-8% dos casos há um outro adenoma contralateral ou uma hiperplasia assimétrica. Outra abordagem ainda consiste em localizar o adenoma com scan (sestamibi), fazer a exploração unilateral e dosar o PTH ainda na sala de cirurgia após a retirada do adenoma (já que o PTH intacto tem vida média de 3 a 4 minutos), desta forma reduz-se o tempo de cirurgia de 90 para 36 minutos. Se o paciente não tem condições cirúrgicas, mas tem indicação de cirurgia, ablação angiográfica ou ablação com injeção local de etanol guiado com US devem ser considerados. Quando existe doença óssea importante, o paciente pode desenvolver "fome óssea" no pós-operatório, a qual se caracteriza por episódio prolongado de hipocalcemia sintomática devido à rápida deposição de cálcio no esqueleto, necessitando de cálcio e vitamina D. Os pacientes que não se submetem à paratireoidectomia devem ter a calcemia monitorizada a cada 6 meses e calciúria, creatinúria e densitometria óssea anualmente. Devem ser orientados a sempre permanecerem bem hidratados e evitarem o uso de tiazídicos. A ingestão de cálcio deve ser normal, pois uma restrição pode levar a aumentos maiores nos níveis de PTH. A reposição de fosfato oral não é recomendada, pois pode induzir a calcificações metastáticas. Nas mulheres pós-menopausa, desde que não exista contra-indicação, faz-se a reposição estrogênica, a qual pode diminuir a calcemia em até 0,5 mg%, apesar de não alterar o PTH nem o fosfato.
HIPOPARATIREOIDISMO
A causa mais comum de hipoparatireoidismo é a secreção inadequada de hormônio paratireóideo depois da interrupção do suprimento sanguíneo ou da retirada cirúrgica do tecido glandular paratireóideo durante a tireoidectomia, paratireoidectomia ou dissecção radical do pescoço. A atrofia das glândulas paratireóides de etiologia desconhecida é uma causa menos comum de hipoparatireoidismo. Novas pesquisas, baseadas em hormônios, estão em curso nos Estados Unidos e poderão trazer benefícios no médio prazo. Os fatores de risco incluem cirurgia recente da tireóide ou pescoço; antecedentes familiares de distúrbio da paratireóide ou antecedente de certos distúrbios endócrinos autoimunes tais como a doença de Addison. A incidência é de 4 em cada 100.000 pessoas.
Os sintomas do hipoparatireoidismo são provocados por uma deficiência de paratormônio que resulta em níveis de fosfato sanguíneo elevados ( hiperfosfatemia) e de cálcio sanguíneo diminuídos ( hipocalcemia). Na ausência do paratormônio, existe absorção intestinal diminuída do cálcio da dieta e reabsorção diminuída do cálcio a partir do osso e através dos túbulos renais. A excreção renal diminuída de fosfato provoca a hipofosfatúria, com os níveis de cálcio baixos resultando em hipocalciúria.
Manifestações clínicas:
A hipocalcemia causa irritabilidade do sistema neuromuscular e contribui para o sintoma principal do hipoparatireoidismo, a tetania – uma hipertonia muscular generalizada, com tremor ou contrações espasmódicas ou descoordenadas que ocorrem com ou sem esforços para fazer movimentos voluntários. Na tetania latente, existem dormências, formigamento e câimbras nos membros, e o paciente se queixa de rigidez nas mãos e pés. Na tetania franca, os sinais incluem broncoespasmo, espasmo laríngeo, espasmo carpopedal ( flexão dos cotovelos e pulsos e extensão das articulações e convulsões). Os outros sintomas englobam ansiedade, irritabilidade, depressão e, mesmo, delírio. As alterações do ECG e a hipotensão também podem acontecer.
Histórico e Achados Diagnósticos:
A tetania latente é sugerida por um sinal de Trousseau ou de Chvostek positivo. O sinal de Trousseau é positivo quando o espasmo carpopedal é induzido ao se ocluir o fluxo sanguíneo para o braço por 3 minutos, com o emprego de um manguito de pressão arterial. O sinal de Chvostek é positivo quando uma percussão aguda sobre o nervo facial, exatamente diante da glândula parótida e anterior ao ouvido, provoca o espasmo ou contratura da boca, nariz e olho. Com freqüência, o diagnostico é difícil por causa dos sintomas vagos, como sensação dolorosa e dor real. Por conseguinte, os exames laboratoriais são particularmente valiosos. A tetania desenvolve-se em níveis séricos de cálcio de 5 a 6 mg/dl ou menos. Os níveis séricos de fosfato mostram-se aumentados, e a radiografia do osso mostra densidade aumentada. A calcificação é detectada nas radiografias dos gânglios basais subcutâneos ou paraespinhais do cérebro.
Tratamento:
O objetivo do tratamento é restaurar o equilíbrio de cálcio e outros minerais no organismo. Suplementos de carbonato de cálcio e vitamina D são geralmente uma terapia para a vida toda. Os níveis sangüíneos requerem monitorização periódica para assegurar a dosagem apropriada. Uma dieta rica em cálcio e baixa em fósforo é recomendada. A terapia de apoio é necessária para um ataque agudo fatal ou tetania hipoparatireóide (contrações musculares prolongadas). O cálcio é administrado por meio de infusão intravenosa. São tomadas precauções para prevenir convulsões e espasmo da laringe. A monitorização cardíaca para freqüências anormais é continuada até que a pessoa esteja estabilizada. Quando o ataque com risco de vida estiver controlado, o tratamento continua com preparações orais.
Expectativas (prognóstico):
O resultado provável é bom se houver um diagnóstico precoce. Alterações dentárias, cataratas e calcificações cerebrais são irreversíveis.
Complicações:
- Tetania aguda que pode causar obstrução respiratória que requer traqueostomia;
- Retardo no crescimento, má-formação dos dentes e retardo no desenvolvimento mental, que podem ocorrer se o hipoparatireoidismo se desenvolver na infância;
- Excesso de tratamento com vitamina D e cálcio, que pode causar insuficiência renal.
- Aumento no risco de anemia pernisiosa, doença de Addison, desenvolvimento de cataratas e doença de Parkinson.
NANISMO
É um crescimento muito lento, com estatura anormalmente pequena por disfunção da hipófise anterior. A altura está abaixo do percentil 3, a velocidade de crescimento é ↓ 4cm/ano e a idade óssea é pelo menos 2 anos menor que a idade cronológica.
A etiologia potencial do nanismo pituitário é variada; na maioria das crianças com baixa estatura não é possível identificar um distúrbio pituitário específico. Embora distúrbios endócrinos constituam uma minoria de todas as causas de retardo de crescimento, é importante tentar identificá-los porque eles são tratáveis. Crianças com hipopituitarismo mais comumente têm um tumor pituitário (craniofaringeoma) ou nenhuma etiologia demonstrável (hipopituitarismo idiopático). A deficiência de GH, sozinha ou em associação com outras anormalidades, é hereditária em 10% dos casos. A baixa estatura na infância, de caráter anormal, pode ser causada por disfunção da glândula pituitária, o que ocasiona uma produção insuficiente de hormônio do crescimento. Essa condição pode ser conseqüência da inexistência da glândula pituitária, trauma ou tumor da glândula pituitária.
O atraso no crescimento pode ser observado no período de lactância e persistir durante a infância. A tabela-padrão apresenta curva de crescimento com medidas de altura seqüenciais, variando de 0 (sem crescimento) a valores mínimos, formando uma curva ascendente discreta (crescimento mínimo). Na puberdade, o crescimento anormal varia conforme o grau de insuficiência da pituitária (incapacidade da pituitária de produzir níveis hormonais adequados, além do hormônio de crescimento).
O nanismo pituitário pode estar relacionado às seguintes deficiências de outros hormônios:
- Tirotropina (controla a produção de hormônios tireoidianos)
- Vasopressina (controla o equilíbrio hídrico do corpo)
- Gonadotropinas (controlam a produção de hormônios sexuais masculinos e femininos)
- ACTH ou hormônios adrenocorticotrópicos (controlam a glândula adrenal e sua produção de cortisol, DHEA e outros hormônios)
Os defeitos da face e do crânio também podem estar associados a anormalidades da pituitária ou de sua função. Uma pequena porcentagem de bebês com fenda labial ou palatina pode apresentar níveis hormonais baixos.
Sintomas:
- Ausência ou atraso do crescimento (estatura)
- Crescimento lento ( crianças entre 0-5 anos)
- Estatura baixa (adultos com altura inferior a 1,52 m)
- Estatura baixa (crianças abaixo do percentual 5 da tabela padrão de crescimento)
- Atraso do desenvolvimento sexual em adolescentes
- Ausência de desenvolvimento sexual
- Dor de cabeça
- Sede excessiva acompanhada de micção excessiva (aumento de volume)
- Aumento do volume de urina.
Sinais e exames:
O exame físico completo, com registro do peso, altura e proporções corporais, mostra sinais de atraso no crescimento e desvio da curva normal de crescimento.
Exames:
- Em geral, recomenda-se uma radiografia da mão ( raio X das extremidades) para se determinar a idade óssea
- Os níveis do hormônio de crescimento confirmam que o distúrbio é causado por disfunção da glândula pituitária
- Podem ser avaliados outros níveis hormonais, visto que o hormônio de crescimento pode não ser um distúrbio isolado.
- Raios-X do crânio (sela pequena, sela vazia, sela aumentada, lesão que ocupa espaço)
- Tomografia computadorizada da cabeça
- Ressonância magnética da cabeça
Tratamento:
Recomenda-se a terapia de reposição de hormônio de crescimento para as crianças que tenham deficiência documentada desse hormônio. Não há um programa padrão de tratamento: administra-se hormônio de crescimento, quando há deficiência do mesmo; quando não se trata de uma deficiência isolada, há a necessidade de reposição de outros hormônios. Os benefícios a longo prazo da terapia de reposição de hormônio de crescimento estão ainda em estudo. Na maioria das crianças, a taxa de crescimento melhora com a administração de hormônios de crescimento, embora sua eficácia diminua com um tratamento prolongado.
Complicações:
Quando não se administra tratamento ao nanismo pituitário, o que resulta é baixa estatura e atraso no desenvolvimento da puberdade. A doença de Creutzfeldt-Jacob é adquirida pela administração de hormônio de crescimento obtida de cadáveres (não mais disponível). O que se utiliza atualmente é um hormônio de crescimento sintético, livre de risco de doença infecciosa.
3. Doenças da Tireóide

A glândula tireóide se encontra na base do pescoço. Tem a forma de uma borboleta; cada lobo, da tireóide está presente em ambos os lados da traquéia. A função da glândula tireóide é produzir, armazenar e liberar hormônios tireoideanos na corrente sangüínea. Estes hormônios, também conhecidos como T3 e T4, agem em quase todas as células do corpo, e ajudam a controlar suas funções. Se os níveis destes hormônios tireoideanos no sangue estão baixos, seu corpo funciona mais lentamente. Esta condição se denomina hipotireoidismo. Se existe um aumento dos níveis dos hormônios tireoidianos no sangue, seu corpo trabalha mais rapidamente. Esta condição se denominahipertireoidismo.
A quantidade de hormônios tireoideanos produzidos pela glândula tireóide é controlada por uma glândula que se encontra no cérebro, chamada pituitária ou glândula hipófise. Outra parte do cérebro, o hipotálamo, ajuda a pituitária.
- O hipotálamo envia informação à glândula hipófise
- A glândula hipófise por sua vez controla a glândula tireóide
A glândula tiróide, a hipófise e o hipotálamo trabalham juntos no controle da quantidade de hormônios tireoideanos no seu corpo.
A glândula hipófise mede em forma constante a quantidade de hormônios tireoidianos no sangue. Se não há suficiente hormônio, este libera mais hormônio estimulante da tireóide (TSH), que indica à tireóide que deve produzir mais hormônio. A glândula tireóide então produz e libera hormônio diretamente na corrente sanguínea.
A glândula hipófise percebe logo que a quantidade de hormônios tireoideanos em seu corpo é a correta. Com os níveis de hormônios estando dentro dos valores normais, a hipófise diminui a produção de TSH a seus valores normais.
HIPERTIROIDISMO
A tireotoxicose é um estado hipermetabólico causado por níveis circulantes elevados de levotiroxina (T4) ou tri-iodotironina (T3) livres. Como é normalmente causada pelo aumento da função tireoidiana, é geralmente chamada de hipertireoidismo. Algumas das causas mais comuns do hipertireoidismo primário incluem:
- Hiperplasia difusa da tireóide associada à doença de Graves (doença auto-imune, responsável por 85% dos casos).
- Bócio multinodular hiperfuncional.
- Adenoma hiperfuncional da tireóide.
As causas secundárias incluem adenomas hipofisários tireotróficos.
Ingestão inapropriada de hormônio tireoidiano exógeno (como tratamento para hipotireoidismo) e várias condições inflamatórias da tireóide são duas causas comuns de tireotoxicose não associada a hiperatividade da glândula tireóide.
Aspectos clínicos:
Os sintomas do hipertireoidismo são causados por hipermetabolismo e estimulação excessiva do sistema simpático. O aumento da taxa metabólica é acompanhado por hiperatividade e subseqüente fadiga, intolerância ao calor, perda de peso. O sinais e sintomas mais importantes relacionados aos principais sistemas orgânicos são os seguintes:
- Sistema Cardiovascular: taquicardia, aumento do débito cardíaco, aumento da incidência de fibrilação atrial, palpitações;
- Sistema Nervoso: nervosismo, ansiedade, hipercinesia, tremores;
- Músculos Esqueléticos: fraqueza e atrofia muscular;
- Sistema Gastrintestinal: aumento do apetite, hipermotilidade intestinal e diarréia;
- Pele: sudorese excessiva;
- Ossos: Osteoporose.
A determinação da concentração sérica de TSH usando ensaios sensíveis de TSH é o exame mais útil para o diagnóstico de hipertireoidismo, já que seus níveis estão diminuídos até mesmo nos estágios iniciais da doença. Um nível baixo de TSH é geralmente visto junto com o correspondente aumento do T4 livre no soro.
Antes do desenvolvimento de opções atuais do tratamento, a taxa de morte do hipertireoidismo era maior que 50%. Agora, diversos tratamentos eficazes estão disponíveis, e com o controle adequado, a morte por hipertireoidismo é rara. O tratamento varia dependendo da causa e também da gravidade dos sintomas. O hipertireoidismo pode ser tratado com medicamentos antitireoidianos, iodo radioativo ou cirurgia.
HIPOTIREOIDISMO
O hipotireoidismo é causado por qualquer alteração estrutural ou funcional que interfira na produção de níveis adequados de hormônio tireoidiano. Assim como ocorre no hipertireoidismo, esse distúrbio é dividido em primário e secundário, dependendo de se o hipotireoidismo resulta de uma anormalidade intrínseca da tireóide ou é resultado de uma doença hipofisiária ou hipotalâmica.
- O hipotálamo primário é responsável pela grande maioria dos casos. Ele pode ser “tireoprivo” (devido a ausência ou perda do parênquima tireoidiano) ou “bociogênico” (devido ao aumento do tamanho da tireóide). A causa mais comum do hipotireoidismo baciogênico em áreas com oferta suficiente de iodo é o hipotireoidismo auto-imune, mais freqüente causado pela tireóide de Hashimoto. Outras causas incluem deficiência de iodo na dieta, erros inatos do metabolismo tireoidiano e drogas que bloqueiam a síntese hormonal.O hipotireoidismo tireoprivo pode seguir a cirurgia da tireóide ou a radiação, pode ser devido a um distúrbio infiltrativo ou raramente pode ter base genética.
- O hipotireoidismo secundário é causado por deficiência de TSH, e o hipotireoidismo terciário (central), por deficiência do TRH.
- O nível de TSH sérico é o teste de triagem mais sensível para hipotireoidismo. O nível de TSH está aumentado no hipotireoidismo primário devido a uma perda da inibição por feedback da produção de TRH e TSH pelo hipotálamo e hipófise, respectivamente.
Os principais sintomas do hipotireoidismo são:
• fraqueza e cansaço, intolerância ao frio, intestino preso, ganho de peso, depressão, dor muscular e nas articulações, unhas finas e quebradiças, enfraquecimento do cabelo, palidez.
Outros sintomas que podem aparecer mais tardiamente são: fala lenta, pele ressecada e espessada, inchaço de mãos, pés e face, diminuição do paladar e olfato, rouquidão, menstruação irregular, dentre outros.
Tratamento:
O objetivo do tratamento é repor a deficiência de hormônio da tireóide. O medicamento mais freqüentemente utilizado é a levotiroxina, mas há outros disponíveis. E o tratamento deverá ser seguido por toda a vida, mesmo se os sintomas desaparecerem, pois são freqüentes as recaídas com a interrupção do medicamento.
Manifestações Clínicas:
As manifestações clínicas abrangem o cretinismo, se a deficiência na tireóide desenvolve-se durante o período perinatal ou na infância, e no mixedema, em crianças mais velhas e adultos.
O cretinismo pode ocorrer na forma endêmica, associada a deficiência de iodo na dieta e bócio endêmico, e na formaesporádica, associada a defeito na síntese hormonal. As características clínicas incluem deficiência no desenvolvimento do sistema esquelético e do sistema nervoso central, manifestada por retardamento mental grave, baixa estatura, hérnia umbilical e características faciais rudes, como olhos espalhados, e língua grande e protusa.
A complicação mais grave do hipotireoidismo é o mixedema que pode levar ao coma, mas que felizmente é a rara. Ele pode ser causado por infecções, exposição ao frio, certos tipos de medicamento e outras doenças. No coma pelo mixedema ocorre alteração do comportamento, diminuição da respiração, queda da pressão sanguínea, do açúcar no sangue e da temperatura. Doenças cardíacas, infecções, infertilidade e abortamento, também podem ocorrer como complicações do hipotireoidismo.
4. Doenças das Adrenais

DOENÇA DE ADDISON
Fisiopatologia:
A doença de Addison, ou insuficiência adrenocortical, ocorre quando a função do córtex supra-renal é inadequada para satisfazer à necessidade de hormônios corticais por parte do paciente. A atrofia auto-imune ou idiopática das glândulas supra-renais é responsável por 80% dos casos de doença de Addison. As outras causas incluem a excisão cirúrgica das glândulas supra-renais ou sua infecção. A secreção inadequada de ACTH a partir da hipófise também resulta em insuficiência supra-renal por causa da estimulação diminuída do córtex supra-renal.
Os sintomas da insuficiência supra-renal também podem resultar da súbita cessação da terapia exógena com hormônios adrenocorticais, a qual suprime a resposta normal do organismo ao estresse interfere com os mecanismos normais de retroalimentação.
Manifestações Clínicas:
A doença de Addison é caracterizada por fraqueza muscular; anorexia; sintomas gastrointestinais; fadiga; edemaciação; pigmentação escura da pele, articulações, joelhos, cotovelos e mucosas; hipotensão; e níveis baixos de glicemia, sódio sérico e potássio sérico. As alterações do estado mental, como a depressão, labilidade emocional, apatia e confusão também estão presentes.
Com a progressão da doença e a hipotensão aguda, o paciente desenvolve a crise adissoniana, caracterizada por cianose, febre e pelos sinais clássicos de choque.
O estresse da cirurgia ou desidratação decorrente da preparação para os exames diagnósticos ou cirurgia pode precipitar uma crise adissoniana ou hipotensiva.
Histórico e achados Diagnósticos:
O início da doença de Addison usualmente ocorre com sintomas inespecíficos. O diagnóstico é confirmado pelos resultados dos exames laboratoriais. Os achados laboratoriais incluem os níveis sanguíneos diminuídos de glicose e sódio, nível sérico aumentado de potássio e um leucograma aumentado.
O diagnóstico é confirmado por níveis baixos de hormônios adrenocorticais no sangue ou na urina e níveis séricos diminuídos de cortisol.
Tratamento Médico:
O tratamento imediato é dirigido no sentido de combater o choque; restaurar a circulação sanguínea, administrar líquidos e corticosteróides, monitorização dos sinais vitais e colocar o paciente em uma posição recostada com as pernas elevadas. A hidrocortisona é administrada por via endovenosa e seguida por glicose a 5% em soro fisiológico normal. As aminas vasopressoras podem ser necessárias quando a hipotensão persiste.
Os antibióticos podem ser administrados quando a infecção precipitou a crise adrenal em um paciente com insuficiência crônica supra-renal.
A ingestão oral pode ser iniciada logo que tolerada pelo paciente. Os líquidos endovenosos são diminuídos aos poucos, quando a ingestão hídrica oral é adequada, para evitar a hipovolemia.
Quando a glândula supra-renal não recupera a função, o paciente necessita de reposição de corticosteróides e mineralocorticóides pelo resto da vida para evitar a recidiva da insuficiência supra-renal e evitar a crise adissoniana em períodos de estresse e doença.
SÍNDROME DE CUSHING
A síndrome de Cushing resulta da atividade adrenocortical excessiva, em vez de deficiente. A síndrome pode resultar da administração excessiva de corticosteróides ou ACTH ou da hiperplasia do córtex supra-renal.
Fisiopatologia:
A síndrome de Cushing pode ser causada por diversos mecanismos, incluindo um tumor da hipófise que produza ACTH e estimule o córtex supra-renal a aumentar a secreção de seus hormônios, apesar de serem produzidas as quantidades adequadas.
A administração de corticosteróides ou de ACTH também pode produzir a síndrome de Cushing. Outra causa menos comum de síndrome de Cushing é a produção ectópica de ACTH por malignidades. Os sinais e sintomas da síndrome de Cushing constituem, principalmente, um resultado da secreção excessiva de glicocorticóides e androgênios, embora a secreção de mineralocorticóides também possa ser afetada.
Manifestações Clínicas:
Quando a produção excessiva de hormônio do córtex supra-renal acontece, a parada do crescimento, obesidade e alterações musculoesqueléticas ocorrem em conjunto com a intolerância à glicose.
Ocorre o catabolismo protéico excessivo, produzindo debilidade muscular e osteoporose.A retenção se sódio e de água acontece em conseqüência da atividade mineral o corticóide aumentada, produzindo hipertensão e insuficiência cardíaca congestiva.
O paciente desenvolve uma aparência de “face de lua cheia” e pode experimentar oleosidade cutânea aumentada e acne. Existe suscetibilidade aumentada à infecção. A hiperglicemia ou os diabetes franco pode desenvolver-se. O paciente também pode relatar ganho de peso, lenta cicatrização de incisões pequenas e escoriações.
As mulheres entre 20 e 40 anos de idade apresentam uma probabilidade cinco vezes maior de desenvolver a síndrome de Cushing. Nas mulheres de todas as idades, a virilização pode ocorrer e conseqüência do excesso de androgênios.
Quando a síndrome de Cushing é uma conseqüência do tumor de hipófise, os distúrbios visuais podem ocorrer por causa da pressão do tumor em crescimento sobre o quiasma óptico.
Histórico e Achados Diagnósticos:
Os indicadores da síndrome de Cushing incluem um aumento nos níveis de sódio sérico e de glicose sanguínea e uma concentração sérica diminuída de potássio, uma redução no número de eosinófilos sanguíneos e o desaparecimento do tecido linfóide.
Um teste de supressão noturna com dexametasona é o teste de varredura mais amplamente utilizado para o diagnóstico das causas hipofisáriase adrenais da síndrome de Cushing e pode ser realizado em base ambulatorial.
Tratamento Médico:
Nos casos em que a síndrome de Cushing é causada por tumores hipofisários em vez de tumores do córtex supra-renal, o tratamento é dirigido para a hipófise. A excisão cirúrgica do tumor por hipofisectomia transesfenoidal é o tratamento de escolha e apresenta uma taxa de sucesso de 90%. A radiação da hipófise também foi bem sucedida, embora possa levar vários meses para controlar os sintomas. A adrenalectomia é o tratamento de escolha nos pacientes com hipertrofia primária da supra-renal.
Quando a síndrome de Cushing é resultante da administração de corticosteróides, é feita uma tentativa de reduzir ou diminuir progressivamente o medicamento até a dose mínima necessária para tratar o processo patológico subjacente. Com freqüência, a terapia em dias alternados diminui os sintomas da síndrome de Cushing e permite a recuperação da responsividade das glândulas supra-renais ao ACTH.
5. Outras
DIABETES INSÍPIDO
O Diabetes insípido é um distúrbio do lobo posterior da hipófise devido a uma deficiência de vasopressina, o ADH. Caracteriza-se por sede intensa ( polidipsia) e grandes volumes de urina diluída. Pode ser secundário ao traumatismo do crânio, tumor cerebral ou ablação cirúrgica ou irradiação da glândula tireóide. Também pode ocorrer com infecções do SNC (meningite, encefalite) ou tumores (doença metastática, linfoma de mama ou pulmão). Outra causa do Diabetes insípido é a falha dos túbulos renais em responder ao ADH; essa forma nefrogênica pode estar relacionada à hipocalcemia, hipercalcemia e inúmeros medicamentos ( ex: lítio, demeclociclina).
Manifestações clínicas:
Sem a ação da vasopressina sobre o néfron distal do rim, tem lugar um enorme débito diário de urina muito diluída, semelhante a água, com uma densidade especifica de 1,001 a 1,005. a urina não contem substâncias anormais, como glicose e albumina. Devido à sede intensa, o paciente tende a beber de 4 a 40 litros de água diariamente, com um desejo especial por água gelada. Na forma hereditária do diabetes insípido, os sintomas primários podem começar no nascimento. Em adultos, ele pode ter um início abrupto ou um estabelecimento insidioso. A doença não pode ser controlada pela limitação dos líquidos, porque a perda de elevados volumes de urina continua, mesmo sem a reposição hídrica. As tentativas para restringir os líquidos fazem com que o paciente experimente um desejo insaciável de liquido e desenvolva hipernatremia e desidratação grave.
Diagnóstico:
Para identificação da causa da poliúria, a glicemia (glicose do sangue) e o cálcio sérico devem ser testados. Os eletrólitos podem se mostrar alterados; hipernatremia (excesso de sódio) são comuns nos casos graves. O exame Parcial de Urina mostra baixos níveis de eletrólitos, e a osmolaridade e densidade urinária são baixas.
Um "teste de privação de água" ajuda a determinar se a DI é causada por:
- Excesso de ingestão de líquidos;
- Um defeito na produção do Hormônio Antidiurético; ou
- Um defeito na resposta renal ao hormônio.
Este teste mede modificações no peso corporal, volume urinário e composição urinária. Dosagens de Hormônio Antidiurético (ADH) no sangue pode ser necessário para o diagnóstico final.
Para distinguir entre as várias formas, a estimulação com desmopressina (um análogo mais potente davasopressina), pode também ser utilizada, injetável, via spray nasal ou via oral. Caso ocorra redução do volume urinário e aumento da densidade urinária a produção do ADH pela glândula pituitária é deficiente e a resposta renal é normal. Caso haja falta de resposta renal a desmopressina não fará efeito.
Se a DI central é suspeitada, testa-se outros hormônios produzidos pela pituitária e realiza-se uma ressonância nuclear magnética (MRI) para descobrir se alguma outra doença está afetando a pituitária, como um prolactinona.
Tratamento Médico:
Os objetivos da terapia são: repor a vasopressina (que é, em geral, um programa terapêutico em longo prazo); garantir a reposição hídrica adequada; procurar e corrigir a patologia intracraniana subjacente. As causas nefrogênicas exigem diferentes abordagens de tratamento.
Reposição de Vasopressina:
A desmopressina (DDAVP), a vasopressina sintética sem os efeitos vasculares do ADH normal, é particularmente valiosa porque apresenta uma duração de ação mais prolongada e menos efeitos adversos que outras preparações previamente utilizadas para tratar a doença. É administrada por via intranasal; o paciente borrifa a solução dentro do nariz através de um tubo plástico calibrado flexível. Duas a quatro administrações diárias parecem controlar os sintomas. O agente lipressina é um agente de ação curta que é absorvido para a corrente sanguínea através da mucosa nasal; entretanto, sua duração pode ser muito curta para pacientes com doença grave. O paciente deve ser observado para a rinofaringite crônica, quando é utilizada a via intranasal de administração. Outra forma de terapia é a administração intramuscular de ADH, o tanato de vasopressina em óleo, usado quando a via intranasal não é possível. É administrado a cada 24 a 96 horas. O frasco do medicamento deve ser aquecido ou agitado vigorosamente antes da administração. A injeção é administrada à noite, de modo que os resultados máximos sejam obtidos durante o sono. As cólicas abdominais constituem um efeito colateral desse medicamento. O rodízio dos locais de injeção é necessário para evitar a lipodistrofia.
Tratamento das causas nefrogênicas:
Quando os diabetes insípidos têm origem renal, os tratamentos previamente descritos são ineficazes. Os diuréticos tiazídicos, a depleção salina branda e os inibidores da prostaglandina (ibuprofeno, indometacina e aspirina) são usados para tratar a forma nefrogênica do diabetes insípido.
Referencias: .http://www.ebah.com.br/content/ABAAAAfgcAC/sistema-endocrino-patologia